Objetivo: Padronizar uma solução de tiossulfato de sódio.
Titulação: Proceder de acordo com o esquema abaixo:
|¯¯¯¯¯¯¯ Na2S2O3
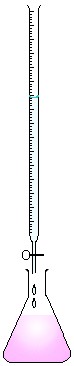 ---------------> 2mL KIO3 0,01 mol/L (padrão primário)
---------------> 2mL KIO3 0,01 mol/L (padrão primário)50 mL água destilada
3 mg de KI
2 mL de H2SO4 (1mol/L)
- Titule agitando com suavidade, o idodo liberado até que esteja próximo do ponto final (amarelo palha);
- Adicione 2 mL de goma de amido e continue a titulação até a mudança de azul para incolor;
- Anote o volume gasto de tiossulfato de sódio (Na2S2O3)
-NUNCA ADICIONAR AMIDO EM CONCENTRAÇÕES ELEVADAS DE IODO!
-O padrão primário escolhido aqui é o iodato de potássio que libera iodo por oxidação de iodeto em meio ácido. O iodo liberado é titulado pelo tiossulfato valendo-se de amigo como indicador.
Dados: Massa molar do tiossulfato de sódio = 158 g/mol
Ref: - Vogel, A.I. Química analítica quantitativa, 1960.
Nenhum comentário:
Postar um comentário